硫酸
| 硫酸 | |
|---|---|
| |

| |

| |

| |
| IUPAC名 Sulfuric acid | |
| 別名 | 漒水、鏹水、綠礬油 |
| 識別 | |
| CAS號 | 7664-93-9 |
| ChemSpider | 1086 |
| SMILES | OS(=O)(=O)O
|
| |
| InChIKey | QAOWNCQODCNURD-UHFFFAOYAC |
| UN編號 | 1830 |
| 歐盟編號 | 231-639-5 |
| RTECS | WS5600000 |
| KEGG | D05963 |
| 性質 | |
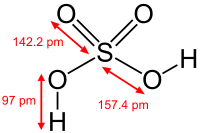
| 化學式 | H2SO4 |
| 摩爾質量 | 98.079 g/mol g·mol−1 |
| 外觀 | 無色無味清澈液體 |
| 密度 | (液)1.84 g/cm3 |
| 熔點 | 10 °C(283 K) |
| 沸點 | 337 °C(610 K) |
| 溶解度(水) | 完全混溶,放熱 |
| pKa | −3, 1.99 |
| 黏度 | 26.7 cP (20 °C) |
| 危險性 | |
| 警示 | R:Template:R35 |
| 安全警告 | S:S1/2 S26 Template:S30 S45 |
| MSDS | ICSC 0362 |
| 歐盟編號 | 016-020-00-8 |
| 歐盟分類 | Toxic (T) Corrosive (C) Dangerous for the environment (N) |
| NFPA 704 | |
| 閃點 | 燒唔着 |
| 相關物質{{{參考}}} | |
| 相關強酸 | 硒酸 鹽酸 硝酸 |
| 有關化學品 | 亞硫酸 Peroxymonosulfuric acid 三氧化硫 Oleum |
| 如果無講明,所有數據都係指25 °C,100 kPa嘅時候嘅情況。 | |
硫酸係一個強無機酸,分子式係H₂SO₄。佢嘅鹽係硫酸鹽。無論幾濃,硫酸都可以溶於水。
硫酸有好多用途,亦都係製造好多化學品所需嘅原料,例如整車用鉛酸電池、處理礦物、整肥料、煉油、污水處理同一啲化學合成都要用到。
整法[編輯]
整硫酸有幾種方法,最常用係鉛室法同接觸法,呢兩個方法都要提煉二氧化硫。
首先,會用克勞斯法或者弗拉施法提取硫,再喺空氣入面燒,變成二氧化硫。另一個提煉二氧化硫嘅方法就係用硫化氫。
- S (s) + O2 (g) → SO2 (g)
- 2 H2S + 3 O2 → 2 H2O + 2 SO2 (−518 kJ/mol)
鉛室法[編輯]
呢個方法用一氧化氮、二氧化氮做催化劑,係較為古老整硫酸嘅方法。而家工業都好少用呢個方法,改用接觸法。
二氧化硫喺水汽、空氣、一氧化氮同二氧化氮共存之下反應,可以整到70%濃度嘅硫酸,反應如下:
- 2NO (g) + O2 (g) → 2NO2 (g)
- SO2 (g) + NO2 (g) → SO3 + NO (g)
- SO3 (g) + H2O (l) → H2SO4 (g)
因為硫酸嘅純度較低,除去唔到一氧化氮同二氧化氮,又
- NO + NO2 + H2O → 2HNO2
- 3NO2 + H2O → 2HNO3 + NO
接觸法[編輯]
接觸法係今時今日工業整硫酸嘅方法,有四步:首先係高溫燒硫化礦或者硫磺,產生二氧化硫;二氧化硫同氧氣喺高溫之下會合成三氧化硫;用濃硫酸吸三氧化硫,產生發煙硫酸;最後用水稀釋發煙硫酸,得到硫酸成品。
喺常壓同攝氏450度之下,將二氧化硫同空氣通過催化劑五氧化二釩(V2O5)[1],整出三氧化硫。
- ;
二氧化硫同氧嘅反應係一個可逆反應。
喺吸收塔入面,三氧化硫會溶喺98%硫酸,形成發煙硫酸。
發煙硫酸經適量嘅水稀釋後,就會形成98%硫酸,並冷卻同儲存。
三氧化硫同水嘅反應非常劇烈,如果直接溶喺水到,就會釋放大量熱能,形成硫酸霧,阻礙溶解過程,而且難以收集。另外,三氧化硫喺硫酸入面嘅溶解度比水高,所以硫酸製造廠唔會將三氧化硫直接溶入水。
- ;
喺反應過程入面,五氧化二釩做咗一個中間物嘅角色:
物理特性[編輯]
硫酸級數[編輯]
雖然可以整到99%硫酸,不過跟住佢會出SO₃,然後濃度就變成98.3%。98%嘅濃度係更加安全,而且呢個濃度係「濃硫酸」嘅常見狀態。唔同濃度係有唔同用途,常見嘅就有[2][3]:
H₂SO₄質量佔總質量百分比 |
密度 (kg/L) |
濃度 (mol/L) |
統稱 |
|---|---|---|---|
| 10% | 1.07 | ~1 | 稀硫酸 |
| 29–32% | 1.25–1.28 | 4.2–5 | 電池酸 (用喺鉛酸蓄電池) |
| 62–70% | 1.52–1.60 | 9.6–11.5 | 鉛室酸 肥料酸 |
| 78–80% | 1.70–1.73 | 13.5–14 | 塔酸 格洛弗塔酸 |
| 95–98% | 1.83 | ~18 | 濃硫酸 |
化學特性[編輯]
同水反應[編輯]
硫酸同水嘅混合係一個好強嘅放熱過程。一定要將硫酸倒入水而唔係將水倒入硫酸。因為呢個方法可以防止喺一下子放出勁多熱力。呢個化學反應最好嘅解釋係因為出咗水合氫離子:
- H2SO4 + H2O → H3O+ + HSO4− K1 = 2.4 x 106 (強酸)
- HSO4− + H2O → H3O+ + SO42− K2 = 1.0 x 10-2 [4]
HSO4-係硫酸氫根,而SO42-係硫酸根。K1同K2都係酸度系數。因為呢個反應喺熱力學入面係有利,所以硫酸係一個好好嘅吸水劑,於是佢畀人用嚟整好多生果乾。
其他化學反應[編輯]
作為一個強酸,硫酸同鹼或者鹼性氧化物產生化學作用出好多相應嘅硫酸鹽。就好似硫酸銅,好多時用嚟電鍍同埋做抗真菌劑,係要用硫酸嚟整:
- CuO (s) + H2SO4 (aq) → CuSO4 (aq) + H2O (l)
硫酸亦都可以用嚟整弱酸。例如佢可以同醋酸鈉反應,換番醋酸CH3COOH出嚟,變成硫酸氫鈉:
- H2SO4 + CH3COONa → NaHSO4 + CH3COOH
而佢同硝酸鉀亦都可以產生複分解反應,整硝酸同埋硫酸氫鉀。濃硫酸亦都可以同氯化鈉產生化學作用,變成氣體氯化氫同亞硫酸氫鈉:
- NaCl + H2SO4 → NaHSO4 + HCl
濃硫酸又可以將糖脫水,變成一嚿碳。硫酸係冇參與呢個化學反應,佢只係分解咗糖,呢個反應會放熱能同埋會出水蒸氣:
- C12H22O11 → 12C + 11H2O
當佢同硝酸直接倒埋一齊,佢同時有酸同埋脫水劑嘅特性,產生硝離子NO+2。化學家就用以上特性,用渠做親電芳香取代反應入面硝化反應嘅催化劑。機理如下:
同金屬反應[編輯]
硫酸會同大部分金屬起置換反應,產生氫氣同埋硫酸鹽。硫酸可以直接同鐵、鋁、鋅、錳、鎂同鎳反應,而熱或者濃硫酸可以同錫、銅反應。但係鉛同鎢就有阻力。不過同錫嘅化應係會產生二氧化硫而唔係氫。凍嘅濃硫酸會令鐵同鋅鈍化,所以可以用佢哋造嘅容器嚟裝濃硫酸。
- Fe (s) + H2SO4 (aq) → H2 (g) + FeSO4 (aq)
- Sn (s) + 2 H2SO4 (aq) → SnSO4 (aq) + 2 H2O (l) + SO2 (g)
危險性[編輯]
| 硫酸嘅危險性 | ||||||
|---|---|---|---|---|---|---|
|
硫酸屬強酸嘅一種,同帶腐蝕性嘅強酸或強鹼一樣,佢識得同蛋白質、脂肪發生酰胺水解作用同埋酯水解作用而達到分解生物組織,造成化學性燒傷。因為佢重識得放出大量熱能,所以亦會造成二級燒傷。一唔小心入眼嘅會導致永久性失明。一唔小心食咗佢,亦會令內臟造成傷害兼冇得醫返轉頭嗰隻。另外,佢啲腐蝕性亦可以整爛好多張紙都得,亦識得將普通嘅糖變成大嚿炭。由於佢有好犀利嘅氧化性,所以佢亦好易同大量金屬產生氧化還原反應。
參考[編輯]
- ↑ 呢個反應亦可以用鉑(Pt)催化,但五氧化二釩較常見,一來價格平過鉑,二來鉑較易同雜質反應而損失。
- ↑ "sulfuric acid", The Columbia Encyclopedia (第6版), 2008, 喺2010-03-16搵到
- ↑ "Sulphuric acid", Encyclopædia Britannica,第26卷 (第11版), 1910–1911, pp. 65–69
- ↑ "Ionization Constants of Inorganic Acids". .chemistry.msu.edu. 喺2011-05-30搵到.













