共價鍵
閱讀設定
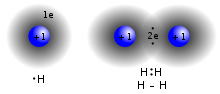
共價鍵係種化學鍵,通過兩個或者好多個非金屬原子一齊用外層電子(即係電子對)後形成。咁樣就可以達到八隅體,好穩定。
分類
[編輯]通常共價鍵有分三類:
喺有機化學入面,重有樣嘢叫單鍵、雙鍵同三鍵,通常用一、兩或者三條綫表示,代表兩個原子之間共用咗幾多粒(對)電子。
配位共價鍵
[編輯]配位共價鍵,通常簡稱配位鍵,講嘅係兩個原子共用緊嘅電子,其實係由一個原子供應嘅。好似一氧化碳噉樣,如果碳同氧之間得雙鍵,噉碳未夠八粒電子,所以氧供應一對電子畀碳,就係所謂配位鍵啦。重有水合氫離子、銨離子等例子。
極性
[編輯]喺氧氣、氯氣等氣體入面,渠組成嘅原子係一樣(都係氧、氯等)。但如果渠組成嘅原子唔同(好似鹽酸入面有氫同氯),咁因爲渠嘅電負性有唔同,所以會搞到共用嘅電子被其中一個原子吸引,電荷分佈得唔夠均衡,分子就會有極性啦。好似鹽酸咁,氯電負性比較大,搶嗮人哋嘅電子,搞到有咗部分負電荷;而分子入面嘅氫,就有咗部分正電荷。電子明顯偏向氯嗰邊,所以鹽酸係個極性分子。
