氨基酸
氨基酸(粵拼:on1 gei1 syun1;英文:Amino acid)係構成蛋白質嘅基本單位,生物體中總共有二十種噉多。氨基酸按照極性分成極性同非極性,而極性氨基酸又分成帶電同唔帶電兩種。極性氨基酸係親水嘅,而非極性氨基酸係疏水嘅。氨基酸係由胺基、羥基、羧基以及一個特別支鏈組成嘅重要生物分子。組成氨基酸嘅最基本元素係碳、氫、氧同氮。氨基酸嘅分類可以通過極性、酸鹼度同支鏈類型(比如含有芳香環、羥基、硫等)嚟分類。氨基酸以蛋白質嘅形式存在,構成人體肌肉,細胞同其他組織除水之外嘅第二大成份。喺蛋白質之外,氨基酸亦參與神經傳遞素同生物合成等嘅關鍵過程。
歷史
[編輯]歷史上第一種氨基酸係喺十九世紀初畀人發現嘅。1806年,法國化學家沃克蘭 (Louis-Nicolas Vauquelin) 同 Pierre Jean Robiquet 喺露筍入邊分離咗一種化合物,之後將佢叫做天冬酰胺,即係第一種畀人發現嘅氨基酸[1][2]。胱氨酸喺1810年畀人發現[3],而佢嘅異構體半胱氨酸就直到1884年先畀人發現[2][4]。甘氨酸同亮氨酸係1820年發現嘅[5]。英文用amino acid表示氨基酸係從1898年開始[6]。1902年,有人發現蛋白質經酵素消化或者酸水解之後會產生氨基酸。Emil Fischer 同 Franz Hofmeister 提出蛋白質係一個氨基酸嘅胺基同另一個氨基酸嘅羧基結合組成嘅線結構,佢哋叫呢種結構做肽[7]。
基本結構
[編輯]
氨基酸嘅分子結構含有胺基(―NH2 )同羧基(―COOH),兼且氨基同羧基都直接連接喺一個-CH-結構上嘅有機化合物。通式係H2NCHRCOOH。根據胺基連接喺羧酸碳原子嘅位置,可分成α、β、γ、δ……氨基酸(C……C―C―C―C―COOH)。
蛋白質經水解後,會產生20幾種α-胺基酸,好似甘氨酸(Glycine)、丙氨酸(Alanine)、纈氨酸(Valine)、亮氨酸(Leucine)、異亮氨酸(Isoleucine)、苯丙氨酸(Phenylalanine)、色氨酸(Tryptophan)、酪氨酸(Tyrosine)、天冬氨酸(Aspartic acid)、組氨酸(Histidine)、天冬酰胺(Asparagine)、穀氨酸(Glutamic acid)、賴氨酸(Lysine)、穀氨酰胺(Glutamine)、甲硫氨酸(Methionine)、精氨酸(Arginine)、絲氨酸(Serine)、蘇氨酸(Threonine)、半胱氨酸(Cysteine)、脯氨酸(Proline)等。
物理化學特性
[編輯]| 縮寫 | 全名 | 中文譯名 | 結構 | 支鏈極性 | 支鏈帶電(pH 7.4) | 親水指數 | 吸收波長(納米) | 分子量 | 等電點 | 解離常數 (羧基) |
解離常數 (胺基) |
pKr(R) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gly (G) | Glycine | 甘氨酸 | 
|
冇極性 | 中性 | -0.4 | 75.07 | 6.06 | 2.35 | 9.78 | * | |
| Ala (A) | Alanine | 丙氨酸 | 
|
冇極性 | 中性 | 1.8 | 89.09 | 6.11 | 2.35 | 9.87 | * | |
| Val (V) | Valine | 纈氨酸 | 冇極性 | 中性 | 4.2 | 117.15 | 6.00 | 2.39 | 9.74 | * | ||
| Leu (L) | Leucine | 亮氨酸 | 冇極性 | 中性 | 3.8 | 131.17 | 6.01 | 2.33 | 9.74 | * | ||
| Ile (I) | Isoleucine | 異亮氨酸 | 冇極性 | 中性 | 4.5 | 131.17 | 6.05 | 2.32 | 9.76 | * | ||
| Phe (F) | Phenylalanine | 苯丙氨酸 | 冇極性 | 中性 | 2.8 | 257,206,188 | 165.19 | 5.49 | 2.20 | 9.31 | * | |
| Trp (W) | Tryptophan | 色氨酸 | 冇極性 | 中性 | -0.9 | 280,219 | 204.23 | 5.89 | 2.46 | 9.41 | * | |
| Tyr (Y) | Tyrosine | 酪氨酸 | 極性 | 中性 | -1.3 | 274,222,193 | 181.19 | 5.64 | 2.20 | 9.21 | 10.46 | |
| Asp (D) | Aspartate | 天門冬氨酸 | 酸性、極性 | 負電 | -3.5 | 133.10 | 2.85 | 1.99 | 9.90 | 3.90 | ||
| His (H) | Histidine | 組氨酸 | 鹼性、極性 | 正電(一成)、中性(九成) | -3.2 | 211 | 155.16 | 7.60 | 1.80 | 9.33 | 6.04 | |
| Asn (N) | Asparagine | 天冬酰胺 | 極性 | 中性 | -3.5 | 132.12 | 5.41 | 2.14 | 8.72 | * | ||
| Glu (E) | Glutamate | 穀氨酸 | 酸性、極性 | 負電 | -3.5 | 147.13 | 3.15 | 2.10 | 9.47 | 4.07 | ||
| Lys (K) | Lysine | 賴氨酸 | 鹼性、極性 | 正電 | -3.9 | 146.19 | 9.60 | 2.16 | 9.06 | 10.54 | ||
| Gln (Q) | Glutamine | 穀氨酰胺 | 極性 | 中性 | -3.5 | 146.15 | 5.65 | 2.17 | 9.13 | * | ||
| Met (M) | Methionine | 甲硫氨酸 | 冇極性 | 中性 | 1.9 | 149.21 | 5.74 | 2.13 | 9.28 | * | ||
| Arg (R) | Arginine | 精氨酸 | 鹼性、極性 | 正電 | -4.5 | 174.20 | 10.76 | 1.82 | 8.99 | 12.48 | ||
| Ser (S) | Serine | 絲氨酸 | 
|
極性 | 中性 | -0.8 | 105.09 | 5.68 | 2.19 | 9.21 | * | |
| Thr (T) | Threonine | 蘇氨酸 | 極性 | 中性 | -0.7 | 119.12 | 5.60 | 2.09 | 9.10 | * | ||
| Cys (C) | Cysteine | 半胱氨酸 | 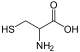
|
冇極性 | 中性 | 2.5 | 250 | 121.16 | 5.05 | 1.92 | 10.70 | 8.37 |
| Pro (P) | Proline | 脯氨酸 | 
|
冇極性 | 中性 | -1.6 | 115.13 | 6.30 | 1.95 | 10.64 | * |
- 電離唔到
參照
[編輯]- ↑ Vauquelin LN, Robiquet PJ (1806). "The discovery of a new plant principle in Asparagus sativus". Annales de Chimie. 57: 88–93.
- ↑ 2.0 2.1 Anfinsen CB, Edsall JT, Richards FM (1972). Advances in Protein Chemistry. New York: Academic Press. pp. 99, 103. ISBN 978-0-12-034226-6.
{{cite book}}: CS1 maint: multiple names: 作者名單 (link) - ↑ Wollaston WH (1810). "On cystic oxide, a new species of urinary calculus". Philosophical Transactions of the Royal Society of London. 100 (0): 223–30. doi:10.1098/rstl.1810.0015.
- ↑ Baumann E (1884). "Über cystin und cystein". Z Physiol Chemie. 8 (4): 299–305. 原先內容歸檔喺2011年3月14號. 喺28 March 2011搵到.
- ↑ Braconnot HM (1820). "Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique". Ann Chim Phys Ser 2. 13: 113–25.
- ↑ "etymonline.com entry for amino". www.etymonline.com. 原著喺2012年10月20號歸檔. 喺19 July 2010搵到.
- ↑ Joseph S. Fruton (1990). "Chapter 5- Emil Fischer and Franz Hofmeister". Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences,.第191卷. American Philosophical Society. pp. 163–165. ISBN 0-87169-191-4.

