元素

元素(粵拼:jyun4 sou3),又叫化學元素(粵拼:faa3 hok6 jyun4 sou3;英文:chemical element),即係無法淨係用化學反應分解嘅物質。
元素係萬物嘅基礎。咩物質都有元素。到2012年為止,總共發現咗118種元素,其中94種係存在喺地球上。
元素最細嘅單位叫做原子。原子係由核子(即質子同中子)同埋電子組成。
背景概念
[編輯]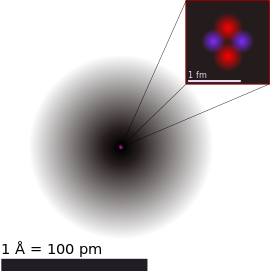
首先思考原子(atom)嘅概念。
根據現代科學對原子嘅理解,一粒原子主要有以下嘅組成部份[1]:
當中原子核仲有得再細分做質子(proton)同中子(neutron)呢兩種再細啲嘅粒子,當中前者帶正電荷,後者冇電荷-所以原子核總體係帶正電荷。電子殼帶有若干數量帶負電荷嘅電子(electron)。質子同中子大粒過電子好多-據估計,質子嘅質量大約係電子嘅 1,836 倍咁多,但喺呈中性電荷嘅原子嗰度,電子殼入面嘅負電荷會啱啱好平衡到原子核入面嘅正電荷[1][2]。
發現原子
[編輯]電子同質子嘅發現源於 19 世紀中物理學上用映像管做嘅研究:當時啲物理學家發現,駁咗電嘅映像管(下圖嘅抽象圖解)條陰極(cathode)會射一啲肉眼睇唔到嘅、有質量而且帶有負電荷嘅嘢出嚟[3][4]-
- 下圖嘅 fluorescent screen(熒幕)係一塊特製嘅表面,已知呢種表面俾輻射射到嗰陣會變色;研究者發現,映像管條陰極對住嗰一忽「熒幕」會變色,而且佢哋仲發現如果佢哋搵嚿物體遮住條陰極,塊「熒幕」上面會有個「影」,即係有一笪空間冇變色(反映嗰笪冇俾輻射射到);上述嘅結果顯示,條陰極應該係射咗啲肉眼睇唔到嘅嘢出嚟。
- 條陰極射出嚟嘅嘢會推郁一啲輕嘅物體;噉即係表示,陰極射出嚟嗰啲嘢有動量(momentum),而一樣嘢有動量就表示嗰樣嘢有質量同速度。有關動量同速度等概念嘅詳情,可以睇吓古典力學。
- 條陰極射出嚟嘅嘢嘅郁動軌跡可以因為磁場(下圖嘅 deflecting coil)而彎曲;噉即係表示,陰極射出嚟嗰啲嘢有電荷(electric charge)-由打前少少嘅古典電磁學研究嗰度已知,係有電荷嘅物體先會因為磁場而改變郁動方向嘅。而且古典電磁學上仲有方法按件物體郁動方向點變(例如「向左定向右」同埋「變咗幾多角度」)嚟知道件物體帶嘅係正定負電荷同埋質量有幾大,進一步嘅分析顯示,條陰極射出嚟嘅嘢帶負電荷,而且質量好細(根據廿一世紀初嘅估計,一粒電子嘅質量大約係 9.1093837015 × 10-31 kg [5])。
而且打後嘅研究仲試過,搵多種用唔同材料造嘅陰極嚟搞同樣嘅實驗,發現用唔同材料造嘅陰極都出到噉嘅現象。於是科學界就萌生咗「電子」嘅概念-原子當中有質量極細、兼且帶負荷嘅組成部份[3][6]。而且電子嘅存在亦都表示,原子入面實係有一啲帶同等正電荷嘅嘢,所以原子整體先會帶中性電荷;而打後由紐西蘭物理學家盧瑟福(Ernest Rutherford)喺廿世紀頭嗰廿年做嘅一系列實驗顯示,用多種材料造嘅陽極會射出一啲帶正電荷、質量大過電子好多嘅嘢出嚟-萌生咗「質子」嘅概念[7][8];而量子力學上嘅發展亦都引致科學界喺 1930 年代初發現中子[9]。

元素概念
[編輯]對原子嘅研究引起咗元素嘅諗頭:古希臘嗰陣嘅人經已有個諗法,諗住「元素係物質嘅基本,是但搵嚿物質,嚿物質都係由元素當中嘅若干款以某啲型式結合埋一齊形成嘅」[註 1][10];由 19 世紀尾至廿世紀初嘅原子研究表示,
- 物質都係由原子組成嘅(睇返上面原子論);
- 原子由質子同電子等再細粒啲嘅嘢組成;
呢兩個諗法自然引起咗一個猜想-「原子會唔會有好多唔同款,而呢啲款之間喺質子數量同電子數量上有差異?」[11]。事實係,早喺現代原子論成形打前,經已有煉金術同化學等領域[註 2]嘅研究者喺度觀念極大量唔同嘅化學反應,發現有某啲類型嘅物質係「冇得靠化學反應分解嘅」,呢啲物質一係就係同第啲物質結合又或者係做另外一啲物質結合嗰陣嘅副產物(「邊樣嘢係結合而成嘅產物」可以由重量等嘅資訊得知)[12];不過要去到廿世紀初,光譜學(spectroscopy;簡化噉講,電子數量唔同嘅原子喺俾光射到嗰陣會有唔同嘅行為,而呢啲差異可以攞嚟搵出一嚿物質有邊啲元素喺入面)等領域上有咗突破先至造就到現代化學上對元素嘅理解[13]。

週期表
[編輯]喺廿一世紀初嘅化學上,元素係跟原子序數(atomic number;定義係「隻元素每粒原子入面有幾多粒質子」)嚟排嘅[14]:
- 一隻化學元素係一個款嘅原子,一隻元素會有個特定嘅原子序數(簡稱「Z」),屬於一隻元素嘅原子冚唪唥都係原子核入面有 Z 咁多粒質子;例如氫(hydrogen;符號:,Z = 1)就係最簡單嗰隻元素,氫原子嘅原子核得嗰 1 粒質子;碳(carbon;符號:,Z = 6)原子嘅原子核有 6 粒質子;而鈾(uranium;符號:,Z = 92)係一隻好重嘅元素,鈾原子嘅原子核有成 92 粒質子咁多;元素係純嘅物質,如果一嚿物質入面嘅所有原子都屬同一隻元素,就冇得用化學方法嚟再去分解佢。而由元素組成嘅物質(包括水同人體)就叫做化學物質(chemical substance)-喺廿一世紀初,一般人日常會接觸到嘅物質都屬化學物質[15]。
- 同一隻元素可能有好多隻唔同嘅同位素(isotope)。「一隻元素嘅同位素」係指呢幾隻同位素之間喺原子序數上一樣,但質量數(mass number;定義係「粒原子入面質子數量同中子數量加埋得出嘅數」)唔同;好似係碳-13(carbon-13)同碳-14(carbon-14)噉就係同位素嘅出名例子,呢兩隻同位素都係原子核入面有 6 粒質子,所以都係屬碳,但碳-14 粒原子核嗰度多咗粒中子-所以碳-14 嘅原子核會重過碳-13 嘅,而且前者仲曉放輻射(可以睇埋放射性定年法)。同一種化學元素嘅同位素因為質子同電子數量一樣,所以化學特性會一樣,但佢哋喺物理特性上可以好唔同[16]。
- 廿一世紀初嘅化學興用元素週期表(periodic table;下圖)嚟列舉化學元素;元素週期表會按原子序數嚟排啲元素,由原子核入面得 1 粒質子嘅氫(Z = 1)開始數起;為咗方便起見,化學家幫每隻元素改好嗮名,而且隻隻元素都有個符號(化學符號)代表,每個符號由 1 至 3 個羅馬字母組成,例如氫嘅符號係「」而碳(Z = 6)嘅符號係「」-等啲人寫起化學相關嘅文章上嚟慳返好多時間精神,唔使吓吓都寫隻元素嘅全名出嚟;一般嚟講,喺元素週期表上同一個橫行或者同一個直行嘅元素都梗係會喺化學特性上有某啲相似性(可以睇吓電子殼同相關嘅概念)[17][18]。

元素嘅發現
[編輯]金屬、非金屬同埋類金屬
[編輯]第一個人哋知嘅元素分類係由Antoine Lavoisier提出嘅,佢建議將元素分類成金屬、非金屬同埋類金屬或者過渡金屬。雖然呢個分類喺現代週期表仲係好實用,但係因為有好多物理性質同化學性質嘅差異,所以畀人拒絕咗。
金屬
[編輯]大部分金屬元素都有我哋通常認為嘅金屬光澤。金屬可以導熱同埋導電,仲可以捶打成薄片(可鍛性),同埋拉成線(延展性)。除咗水銀(熔點係 -39°C)係液體之外,其他喺室溫下都係固體。有兩種金屬嘅熔點少少高過室溫:銫係 28.4°C,鎵係 29.8°C。另一方面,好多金屬嘅熔點都好高。例如,鉻嘅熔點係 1900°C。
金屬傾向有低電離能,所以喺化學反應中容易氧化(失去電子)。常見嘅金屬相對容易氧化。好多金屬會同各種常見物質氧化,包括氧氣同埋酸。
金屬通常用嚟做結構材料、製造容器、導熱同埋導電。好多金屬離子喺生物學上都有重要功能:鐵、鈣、鎂、鈉、鉀、銅、錳、鋅、鈷、鉬、鉻、錫同埋釩。
有好多種金屬,例如:
鐵 (Fe):又叫做鋼,係地殼入面最常見嘅金屬之一,仲構成咗地球核心,喺嗰度以液體狀態存在。佢最突出嘅特性,除咗堅硬同埋脆之外,就係佢嘅強烈鐵磁性。將佢同碳合金可以得到鋼。
鎂 (Mg):係地球第三豐富嘅元素,喺地殼同埋溶解喺海洋入面都有。喺自然界從來唔會以純態出現,而係以離子形式存在於鹽類入面。對生命嚟講係必需嘅,可以用嚟做合金,仲好易燃。
金 (Au):一種黃色嘅貴金屬,軟、有光澤,同大多數化學物質都冇反應,除咗氰化物、水銀、氯同埋鹼液。喺人類經濟文化歷史入面扮演咗重要角色,係財富嘅象徵同埋貨幣嘅支撐。
銀 (Ag):另一種貴金屬,係白色、有光澤、可延展同埋可鍛性。喺自然界入面可以喺各種礦物入面搵到,或者以純元素嘅形態存在,因為佢喺地殼入面好常見。係已知最好嘅導熱同埋導電體。
鋁 (Al):一種好輕嘅金屬,冇鐵磁性,係地殼入面第三豐富嘅元素。喺工業同埋冶金方面好有價值,因為可以通過合金製造出更加耐用但仲係好靈活嘅變種。密度低,仲好抗腐蝕。
鎳 (Ni):一種白色嘅金屬,好延展同埋可鍛性,係好嘅導電體同埋導熱體,仲有鐵磁性。係其中一種密度高嘅金屬,同銥、鋨同埋鐵一樣。對生命好重要,因為係好多酶同埋蛋白質嘅組成部分。
鋅 (Zn):係一種過渡金屬,同鎘同埋鎂相似,經常用嚟做鍍鋅,即係用嚟保護其他金屬。佢喺冷嘅情況下好難塑性變形,所以通常喺 100°C 以上先至加工。
鉛 (Pb):鉛係唯一可以阻擋放射性嘅元素。佢係一種好特別嘅元素,因為佢嘅分子結構好靈活,容易熔化,仲相對抗得住強酸,好似硫酸或者鹽酸咁。
錫 (Sn):一種重金屬,容易氧化,喺好多合金入面都有用到,用嚟增加抗腐蝕性。當你彎曲佢嘅時候,會發出一種好特別嘅聲音,人哋叫做「錫嘅叫聲」。
鈉 (Na):鈉係一種軟嘅鹼金屬,銀白色,存在於海鹽同埋岩鹽礦物入面。佢好容易發生反應,會氧化,同水混合嘅時候會發生劇烈嘅放熱反應。係所有已知生物體嘅重要組成部分之一。
非金屬
[編輯]非金屬嘅外觀差異好大,冇光澤,通常係導熱同埋導電嘅差導體。佢哋嘅熔點比金屬低(雖然鑽石,即係碳嘅一種形態,喺正常壓力同埋溫度下嘅熔點係 3700°C)。喺普通情況下,有幾種非金屬以雙原子分子嘅形式存在。呢個名單包括五種氣體(H₂、N₂、O₂、F₂ 同埋 Cl₂),一種液體(Br₂)同埋一種易揮發嘅固體(I₂)。其他嘅非金屬都係固體,可以好硬好似鑽石,又可以好軟好似硫磺。同金屬相反,佢哋好脆,唔可以拉成絲或者壓成薄片。喺室溫下可以以三種物質狀態存在:有氣體(好似氧氣),液體(溴),同埋固體(好似碳)。佢哋冇金屬光澤,唔反光。好多非金屬喺所有生物體入面都有:碳、氫、氧、氮、磷同埋硫都有大量存在。其他嘅就係微量元素:氟、矽、砷、碘、氯。
金屬同非金屬嘅比較
[編輯]金屬
- 有光澤;有唔同顏色,但大多數都係銀色。
- 固體嘅金屬可以鍛造同埋延展。
- 好嘅導熱體同埋導電體。
- 差唔多所有金屬氧化物都係鹼性離子固體。
- 喺水溶液入面傾向形成陽離子。
- 外層通常只有少量電子,通常係三個或者更少。
- 要注意嘅係,雖然呢啲特徵好普遍,但都有啲例外,例如錳雖然係金屬,但係可以形成酸。
非金屬
- 冇光澤;有唔同顏色。
- 固體通常好脆;有啲硬,有啲軟。
- 係差嘅導熱體同埋導電體。
- 大部分非金屬氧化物係分子物質,會形成酸性溶液。
- 喺水溶液入面傾向形成陰離子或者氧陰離子。
- 外層有四個或者更多嘅電子*。除咗氫同埋氦之外,其他都更加接近類金屬。
喺週期表入面嘅位置
[編輯]金屬
對應週期表左邊同埋中間嘅元素(第 1 族(除咗氫)到第 12 族,喺之後嘅族群入面沿住一條曲線,大概喺鋁(第 13 族)、鍺(第 14 族)、銻(第 15 族)同埋釙(第 16 族)上面,越往下金屬特性就越強)。
非金屬
對應週期表右邊,即係頭先講嗰條曲線右邊嘅元素。
元素同原子序
[編輯]化學元素係每一種最基本嘅物質,即係一種純物質(或者一種特定嘅化學種)。佢永遠以同一類型嘅原子形式出現,因此唔可以再分解成更簡單嘅物質。每種元素都由擁有相同原子序(即相同數目質子)嘅原子組成,喺性質同基本特性上都同其他元素有分別。舉個例,金元素嘅特性就同鐵元素或者氧元素唔同。化學元素通常用唔同嘅符號來表示。
命名
[編輯]而其他元素係由清朝化學家徐壽命名,好似鈉、鉀咁樣,依種一般係根據化學元素嘅歐洲名嘅第一個音來譯出來,再根據性質(金屬、氣體)加個部首(如果係金屬,部首係金等)。但有幾種元素嘅名而家已經唔用,例如養氣(氧氣)、綠氣(氯氣)、淡氣(氮氣)等等。佢哋一般有意思,好似氧氣養活所有嘢,所以叫養氣、氯氣係綠色,所以叫綠氣等。
化學符號
[編輯]化學符號係用嚟識別化學元素同化合物嘅縮寫或者符號。一啲常見元素同佢哋嘅符號有:C(碳)、O(氧)、N(氮)、H(氫)、Cl(氯)、S(硫)、Mg(鎂)、Al(鋁)、Cu(銅)、Ar(氬)、Au(金)、Fe(鐵)、Ag(銀)、Pt(白金)。呢啲符號係1814年由貝采利烏斯提出嚟取代煉金術符號同道爾頓喺1808年解釋佢嘅原子理論時用過嘅符號。
大多數化學符號都係由元素名稱嘅字母衍生出嚟,主要係拉丁文,但有時都會用英文、德文、法文或者俄文。符號嘅第一個字母用大楷寫,第二個字母(如果有嘅話)就用細楷。一啲自古已知嘅元素,佢哋嘅符號通常嚟自拉丁文名稱。例如,Cu 嚟自 cuprum(銅)、Ag 嚟自 argentum(銀)、Au 嚟自 aurum(金)、Fe 嚟自 ferrum(鐵)。呢套用嚟表示化學元素嘅符號係全世界通用嘅。元素符號可以用嚟做元素嘅縮寫,但係喺公式同方程式入面,佢哋都用嚟表示元素嘅固定相對數量。符號通常代表分子或者其他化學物種入面嘅一個元素原子。不過,原子有固定嘅質量,叫做相對原子質量,所以符號都可以代表一摩爾。
例子
[編輯]氣體
[編輯]金屬
[編輯]其他
[編輯]半金屬
[編輯]註釋
[編輯]睇埋
[編輯]攷
[編輯]- ↑ 1.0 1.1 Burrows, A., Holman, J.; Parsons, An.; Pilling, G.; Price, G. (2009). Chemistry3. Italy: Oxford University Press.
- ↑ Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Inorganic Chemistry. 3rd Ed. Harlow, Essex: Pearson Education.
- ↑ 3.0 3.1 Plücker, M. (1858-12-01). "XLVI. Observations on the electrical discharge through rarefied gases". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 16 (109): 408–418.
- ↑ Leicester, H.M. (1971). The Historical Background of Chemistry. Courier Dover. pp. 221-222.
- ↑ Electron. Encyclopedia Britannica.
- ↑ O'Hara, J. G. (March 1975). "George Johnstone Stoney, F.R.S., and the Concept of the Electron". Notes and Records of the Royal Society of London. Royal Society. 29 (2): 265-276.
- ↑ Wien, Wilhelm (1904). "Über positive Elektronen und die Existenz hoher Atomgewichte". Annalen der Physik. 318 (4): 669–677.
- ↑ Petrucci, R. H.; Harwood, W. S.; Herring, F. G. (2002). General Chemistry (8th ed.). Upper Saddle River, N.J. : Prentice Hall. p. 41.
- ↑ Discovery of the Neutron.
- ↑ Partington, J. R. (1937). A Short History of Chemistry. New York: Dover Publications.
- ↑ Lavoisier, A. L. (1790). Elements of chemistry translated by Robert Kerr. Edinburgh. pp. 175-6.
- ↑ Boyle, R. (1661). The Sceptical Chymist. London.
- ↑ Croswell, K. (1996). Alchemy of the Heavens. Anchor.
- ↑ Carey, G.W. (1914). The Chemistry of Human Life. Los Angeles.
- ↑ Hale, Bob (2013-09-19). Necessary Beings: An Essay on Ontology, Modality, and the Relations Between Them. OUP Oxford.
- ↑ Soddy, Frederick (12 December 1922). "The origins of the conceptions of isotopes" (PDF). Nobelprize.org. p. 393.
- ↑ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press.
- ↑ Van Spronsen, J. W. (1969). The Periodic System of Chemical Elements: A History of the First Hundred Years. Amsterdam: Elsevier.






